Los hidrocarburos son compuestos que solo contienen carbono e hidrógeno. Se dividen en dos categorías:
hidrocarburos alifáticos y aromáticos.
Los hidrocarburos alifáticos incluyen tres tipos de compuestos: alcanos, alquenos y alquinos. Los alcanos son
hidrocarburos que contienen solo enlaces simples
carbono-carbono, los alquenos son hidrocarburos que
contienen dobles enlaces carbono-carbono y los alquinos son
hidrocarburos que contienen solo un triple
enlace.
El segundo grupo lo forman los hidrocarburos aromáticos. El compuesto más importante en esta familia es el benceno.
Alcanos
Los alcanos son compuestos hechos de carbono e hidrógeno y
contienen solo enlaces simples
carbono-carbono. Satisfacen la fórmula general CnH2n + 2,
donde n es el número de carbonos en la
molécula. Los alcanos cuyos átomos de carbono están unidos
continuamente (sin ramificar) se denominan
alcanos de cadena lineal.
Alcanos lineales
Alcanos con ramificaciones se denominan alcanos de cadena ramificada.
Alcanos ramificados
Nomenclatura de alcanos
En el sistema de nombres de la IUPAC, el nombre consta de
tres partes: prefijo y sufijo principal.
El prefijo indica el sustituyente en la molécula; el sufijo
indica el grupo funcional de la molécula; la
parte principal es el número de carbonos. Los alcanos se
pueden dividir en las siguientes siete etapas:
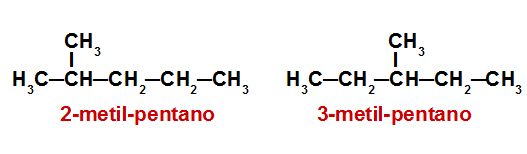
Regla 1.- Determinar el número de carbonos en la cadena más
larga (denominada cadena principal de
alcanos). Tenga en cuenta en la figura que no siempre es una
cadena horizontal.
Elección de la cadena principal
El nombre del alcano se termina en el nombre de la cadena
principal (octano) y va precedido por los sustituyentes.
Regla 2.-Los sustituyentes se nombran cambiando el alcano final del grupo alquilo (metilo, etilo, propilo, butilo) del que se deriva. En el nombre de alcano, el sustituyente se encuentra antes del nombre de la cadena principal con un localizador que indica su posición en la cadena principal. Complete la numeración de la cadena principal para asignar un ancla mínima para los sustituyentes.
Nomenclatura de
los sustituyentes
Regla 3-Si tenemos varios sustituyentes, los ordenamos alfabéticamente antes del localizador. Complete la numeración de la cadena principal para que los sustituyentes juntos ocupen la posición más pequeña.
Si varios sustituyentes son iguales, se emplean los prefijos di, tri, tetra, penta, hexa, para indicar el número de veces que aparece cada sustituyente en la molécula. Los localizadores se separan por comas y debe haber tantos como sustituyentes.

Los prefijos de cantidad no se tienen en cuenta al ordenar
alfabéticamente.
Regla 4.- Si estamos a la misma distancia del primer sustituyente al numerar la cadena principal en ambos extremos, entonces miraremos los demás sustituyentes y la numeración para que ocupen la posición más pequeña.
Regla 5.- Si se obtiene el mismo localizador numerando en ambas direcciones, se asigna el localizador más bajo al sustituyente que se clasifica primero en orden alfabético.
Regla 6.- Si dos o más acordes tienen la misma longitud, el que tenga el mayor número de sustituciones es el principal.

Regla 7. Aunque se recomienda una nomenclatura sistemática, la IUPAC acepta algunos sustituyentes con nombres comunes.

Los nombres sistemáticos de estos sustituyentes se obtienen numerando la cadena a partir del carbono que conecta el átomo de carbono principal. Los nombres de los sustituyentes terminan con el nombre de la cadena más larga con -ilo y se forman en orden alfabético antes de los nombres de los sustituyentes en esta cadena secundaria. Veamos un ejemplo:

Isomería
Los isómeros son compuestos que tienen diferencias en la estructura o configuración espacial, incluso si tienen la misma fórmula molecular, y a menudo tienen diferencias en las propiedades físicas y químicas.
Existen diferentes clases de isomería, pudiendo clasificarse en dos grandes grupos:
Un grupo es el llamado isomerismo plano, que se ocupa de las diferencias estructurales de las cadenas de carbono, la disposición de los sustituyentes o la diferente organización de los componentes, formando así uno u otro grupo funcional, que producirá diferentes compuestos orgánicos.
El otro tipo es isomerismo estérico o estereoisomerismo. Este tipo de isomería se ocupa de la disposición de diferentes grupos funcionales o sustituyentes en el espacio y estudia sus interrelaciones en la cadena de carbono.
Isomería plana:
Dentro de la isomería estructural plana, existen tres
subtipos:
-Isomería de posición
-Isomería de función
La isomería en cadena:
es una característica de los compuestos que se distinguen entre sí solo en el orden en que sus átomos están conectados dentro de la molécula. Por tanto, presentan diferencias en propiedades físicas y químicas.
Ocurre cuando los isómeros difieren en la posición del grupo funcional en la cadena de carbono.
Por ejemplo, las fórmulas moleculares del 1-butanol y del
2-butanol son C4H9O, y las fórmulas
estructurales son diferentes en cada caso.
Isomería de función:
Este tipo de isomería ocurre cuando los grupos funcionales de los isómeros son diferentes.
Aunque los isómeros funcionales tienen la misma fórmula molecular, pertenecen a diferentes grupos,
por lo que se comportan como sustancias diferentes porque en
realidad son iguales.
Isomería Optica
Los isómeros ópticos son isómeros ópticos que exhiben
diferentes comportamientos en la luz polarizada.
Por ejemplo, en relación con el ángulo en el que el
observador dirige su línea de visión hacia la fuente
de luz, se desvía del plano de polarización en un cierto
ángulo con respecto a un punto fijo.
De acuerdo con qué lado está sesgado, hay dos tipos:
Levógiro, en el caso del isómero con desvío hacia la izquierda.
Dextrógiro, cuando un isómero se desvía el mismo ángulo que el levógiro, pero hacia la derecha.

Se dice que este tipo de isómeros son ópticamente activos.
Esta isomería está causada por la presencia de átomos de carbono asimétricos en la molécula, es decir, cuatro sustituyentes diferentes.
Los cicloalcanos son alcanos
conectados en los extremos de la cadena para formar un anillo. Tienen dos
hidrógenos menos que el alcano del que se derivan, por lo que su fórmula
molecular es CnH2n. Se nombran usando el prefijo "cyclo" seguido del
nombre del alcano.

Es frecuente representar las
moléculas indicando sólo su esqueleto. Cada vértice representa un carbono unido
a dos hidrógenos.

Las reglas IUPAC para nombrar
cicloalcanos son muy similares a las estudiadas en los alcanos.
Regla 1.- En cicloalcanos con un
solo sustituyente, se toma el ciclo como cadena principal de la molécula. Es
innecesaria la numeración del ciclo.

Si la cadena lateral es compleja, puede tomarse como cadena principal de la molécula y el ciclo como un sustituyente. Los cicloalcanos como sustituyentes se nombran cambiando la terminación –ano por –ilo.
Regla 2.- Si el cicloalcano tiene
dos sustituyentes, se nombran por orden alfabético. Se numera el ciclo
comenzando por el sustituyente que va antes en el nombre.

Regla 3.- Si el anillo tiene tres
o más sustituyentes, se nombran por orden alfabético. La numeración del ciclo
se hace de forma que se otorguen los localizadores más bajos a los
sustituyentes.

En caso de obtener los mismos
localizadores al numerar comenzando por diferentes posiciones, se tiene en
cuenta el orden alfabético.
- A temperatura ambiente y a una atmósfera, los cuatro primeros son gases, del C5 al C16 son líquidos, del C17 y más son sólidos.
- Los puntos de ebullición aumentan al aumentar la cadena.
- Los puntos de fusión aumentan levemente (par o impar).
- Son atacados por el oxígeno a elevadas temperaturas.
- Se descomponen por temperaturas altas en ausencia de oxígeno.
- Sufren reacciones de halogenación.
- PIROLISIS: Se efectúa la escisión de alcanos de peso molecular grande en moléculas de menor tamaño.

Al girar un grupo metilo alrededor del eje C-C, empezando a partir de la conformación alternada,
la distancia entre los hidrógenos disminuye, dando lugar a un aumento en la repulsión entre los
pares enlazantes de los enlaces C-H.
En el punto de eclipse, la molécula tiene su contenido máximo de energía.
El cambio de energía asociado a la rotación alrededor de un enlace se llama energía rotacional o
torsional.
En este caso la superficie de energía potencial (SEP) es una función sinusoidal de periodo 120º y
de amplitud 2.9 kcal/mol.

En este caso también las formas extremas son las alternadas y la eclipsadas.
La barrera en este caso es mayor que en el etano debido al impedimento estérico que
en este caso involucra un metilo y un hidrógeno.
La variación es sinusoidal porque tenemos el mismo efecto en cada giro.

La tensión de anillo de un
ciclobutano plano se debe a dos factores: la tensión
angular debida a la compresión de
los ángulos de enlace desde el ángulo
tetraédrico de 109,5º hasta 90º,
y la tensión torsional debida al eclipsa miento de
los enlaces C-H.

La tensión angular y la tensión torsional en el ciclopropano hacen que el tamaño de este anillo sea extremadamente reactivo.

La conformación del ciclopentano
está ligeramente doblada, como la forma de un sobre. Esta conformación plegada reduce
el eclipsa miento de los grupos CH2 adyacentes.

El análisis conformacional del
ciclohexano indica que las barreras del potencial son
mayores y por lo tanto les
podemos medir fácilmente en comparación con las otras
familias
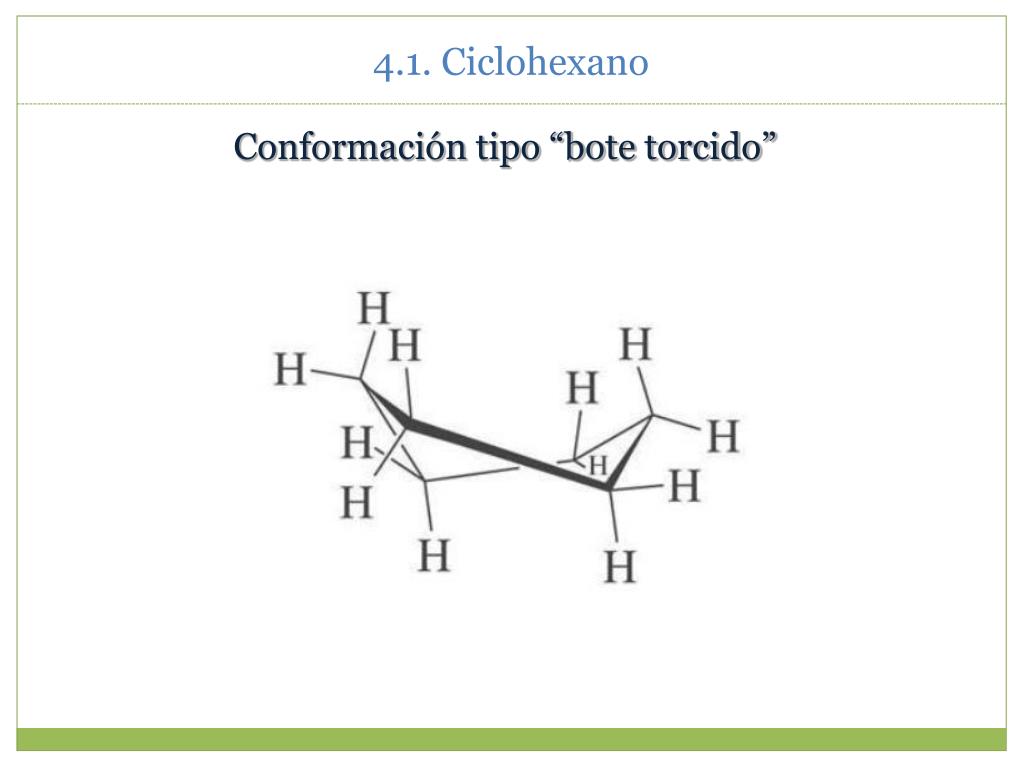
El confórmero silla es el más estable.
Las otras conformaciones bote y twist (bote retorcido) son menos estables.








Colocar las imágenes con mejor definición; agregar ejercicios de nomenclatura de alcanos y además ordenar las páginas en orden
ResponderBorrar